通过小鼠碳粒廓清试验、抗体分泌细胞测定(QHS法)试验及ConA诱导的小鼠脾淋巴细胞转化试验,研究了康美键胶囊的免疫调节作用。
|
|
实验一 小鼠碳粒廓清试验
|
-
实验动物:昆明种小鼠40只,♂18~229g,湖北医科大学实验动物中心提供。
-
药品和试剂:
康美键胶囊:广东快特新生化食品实业有限公司提供,批号:用950708。0.5%的冰醋酸配成2%、1%及0.5%的混悬液,用前摇匀。
注射用墨汁:将印度墨汁原液用生理盐水稀释4倍。
Na2C03溶液:取0.1gNa2C03,加蒸馏水至100ml。
-
仪器: UV-120紫外分光光度计,日本岛津。
-
分组与处理:小鼠随机分为四组,每组10只,即对照组(0.5%冰醋酸0.5ml/只);高、中、低剂量组(分别为康美键胶囊1g/kg、0.5g及0.25g/kg,不同浓度的药液按0.5ml/只灌胃给予,每日一次,连续三周。
小鼠尾静脉按0.1ml/10g注入稀释的印度墨汁,立即计时,注入后2.10min分别从内眦静脉丛取血20ul,并将其加到2mINa2C03溶液中,混匀,用岛津一120分光光度计在600nm波长处测定光密度(0D),以Na2co3溶液作空白对照管,将小鼠处死,取肝脏和脾脏,用滤纸吸干表面血污,分别称重。
按下式计算吞噬指数α
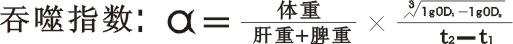
-
数据处理:用方差分析进行数据统计处理。
-
结果
表1 康美键胶囊对小鼠碳粒廓清的影响(x±SD)
|
组别
|
动物数
|
给药剂量(g/kg)
|
吞噬指数(α)
|
|
对照组
|
10
|
0
|
3.99±0.48
|
|
高剂量组
|
10
|
1
|
4.77±0.61**Δ
|
|
中剂量组
|
10
|
0.5
|
4.71±0.59**
|
|
低剂量组
|
10
|
0.25
|
4.09±0.64
|
|
**:与对照组比p<0.01;Δ:与低剂量组比P<0.05
高、中剂量组的吞噬指致显著高于对照组的吞噬指数(均为P<0.01),高剂量组的吞噬指数显著高于低剂量的吞噬指数(P<0.05),低剂量组与对照组相比,差别无显著性。
结果表明高、中剂量康美键胶囊能促进巨噬细胞的吞噬功能,具有增强机体非特异免疫系统功能的作用。
|
|
实验二 脾脏抗体生成细胞的测定(QHS法)
|
-
实验动物:BALB/C种小鼠,♀,16~20g,湖北省实验动物中心提供。
-
药品和试剂(康美键胶囊:同实验)。
绵羊红细胞(SRBc):将绵羊血加入Alseverˊs血球保存液中,分离红细胞。用pH7.2PBS配成0.2%及5%血球液备用。
补体:采集健康豚鼠血,分离血清,按10:1(v/v)将血清加入压积SRBC中,置4℃30min,经常震荡,离心(2000r/min,10min),取上清液备用。
-
仪器: uv?/FONT>120紫外分光光度计,日本岛津;恒温水浴箱:北京医疗设备厂。
-
分组与处理:分组及给药方法同实验一,第17天以5%SRBC0.2ml腹腔注射使小鼠致敏,同时继续给药。免疫后4天放血致死,用PH7.2PBS按20mg脾重/ml制成脾细胞悬液。在15×l00mm试管中加入1ml免疫脾细胞(对照组以pH7.2PBS代替),1m10.2%SRBC、 lml1:10稀释补体,充分温匀后置37℃温育1h,3000r/min离心 5min。用413nm波长测其上清液中红细胞裂解释放的血红蛋白(Hb)量(以OD值表示)。
-
数据处理:用方差分析进行数据统计处理。
-
结果
表2 康美键胶囊对小鼠脾脏抗体生成细胞的影响(x±SD)
|
组别
|
动物数
|
剂量(g/kg)
|
抗体生成细胞(OD表示Hb释放量)
|
|
对照组
|
10
|
0
|
0.220±0.020
|
|
高剂量组
|
10
|
1
|
0.262±0.017**ΔΔ
|
|
中剂量组
|
10
|
0.5
|
0.245±0.023*
|
|
低剂量组
|
10
|
0.25
|
0.225±0.025
|
|
*:与对照组相比P<0.05 **:与对照组相比p<0.01
ΔΔ:与低剂量组比P<0.01
|
|
高、中剂量组的脾脏抗体生成细胞显著高于对照组(分别为P<0.01及P<0.05),高剂量组的脾脏抗体生成细胞显著高于低剂量组(P<0.01),低剂量组与对照组相比差异无显著性。
结果表明高、中剂量康美键胶囊能显著促进脾脏抗体生成细胞的功能,即提高B淋巴细胞体液免疫功能的作用。
|
|
实验三 ConA诱导的小鼠脾淋巴细胞转化试验MTT法)
|
-
实验动物:昆明种小鼠,♂18~22g,湖北医科大学实验动物中心提供。
-
药品和试剂:(康美键皎囊:同实验一)。
RPMl1640细胞培养液:GiBco BRL生产;小牛血清:GiBco BRL生产。2一硫基乙醇(2-ME):Sigma生产;刀豆蛋白A(ConA):Sigma生产。噻唑蓝(MTT):Serva生产;Hanks液及PBS缓冲液由国产AR纯试剂自行配制。
-
仪器:
超净工作台:苏州通风设备厂生产;二氧化碳培养箱:Water-Packed生产;24孔培养板:Evergreen Scientific生产。
-
分组与处理:
①分组及给药方法同实验一。
②脾细胞悬液制备
无菌取脾,置于盛有适量无菌Hanks液的小平皿中,用镊子轻轻将脾撕碎、制成单个细胞悬液,经200目筛网过滤,用Hanks液洗3次,每次离心10min(1000r/min)。然后将细胞悬液溶于2ml的完全培养液中,用台盼兰染色计数活细胞数(95%以上),调整细胞浓度为2×106个/ml。
③淋巴细胞增殖反应
将细胞悬液分两孔加入24孔培养板中,每孔1ml。一孔加50ulConA液(相当于5ug/ml),另一孔作为对照。置5%C02、37℃培养72h。培养结束前4h,每孔轻轻吸去上清液0.7ul、加入0.7ml不含小牛血清的RPMIl640培养液,同时加入MTT(5mg/ml )50ul/孔。继续培养4h,培养结束后,每孔加入lml酸性异丙醇,吹打混匀,使紫色结晶完全溶解,将溶解液移入比色皿中,以570nm波长在分光光度计上比色测定。
-
数据处理
用加ConA孔的光密度减去不加ConA孔的光密度值表示淋巴细胞的增殖能力,采用方差分析进行数据统计。
-
结果
表3 康关键胶囊对ConA诱导的小鼠脾淋巴细胞转化的影响(x±SD)
|
组别
|
动物数
|
剂量(g/kg)
|
淋巴细胞转化数
(以MTT OD差值表示)
|
|
对照组
|
10
|
0
|
0.16±0.03
|
|
高剂量组
|
10
|
1
|
0.26±0.01**ΔΔ
|
|
中剂量组
|
10
|
0.5
|
0.23±0.03**Δ
|
|
低剂量组
|
10
|
0.25
|
0.18±0.02
|
|
**:与对照组相比P<0.01;Δ:与低剂量组比P<0.05;
ΔΔ:与低剂量组比P<0.01
高、中剂量组淋巴细胞转化数显著高于对照组(均为P<0.01),同时显著高于低剂量组(分别为P<0.01及P<0.05),低剂量组与对照组相比差别无显著性。
|
|
结果表明,康美键胶囊大,中剂量能增强小鼠淋巴细胞的增殖能力,即具有促进机体细胞免疫功能的作用。
|
|
结 论
|
|
结果表明,康美键胶囊能剂量依赖性地促进巨噬细胞的吞噬功能及脾脏细胞抗体生成能力,增强淋巴细胞的增殖能力,即具有促进机体非特异免疫的功能,说明康美键胶囊有显著的免疫增强作用。
|
课题负责人:刘惟莞(教授)
参加者:石明健(讲师)
王红英(高级实验师)
程虹(研究生)
余恩欣(研究生)
王芳(研究生)
曾加雄(研究生)
资料整理者:石明健(讲师)
|


